Atualização de medicamentos com exportação
💊 Foi publicada a Deliberação n.º 96/CD/2025, que atualiza a lista de medicamentos com exportação temporariamente suspensa.
Esta medida visa garantir a normalização do abastecimento dos medicamentos críticos que estiveram em rutura em agosto, bem como daqueles que estão a ser abastecidos com autorização de utilização excecional.
A lista completa está disponível, em formato eletrónico, na área de Gestão da Disponibilidade do Medicamento.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/11603253
📢 Atualização na Comercialização de Medicamentos
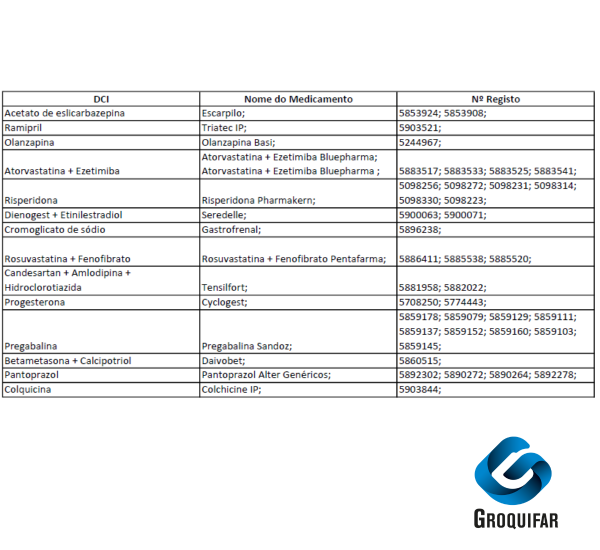
A partir de hoje, 1 de setembro de 2025, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
Atorvastatina Zidrium para Atorvastatina Teva
N.º registo 5317037 para N.º registo 5889209
N.º registo 5317052 para N.º registo 5889233
N.º registo 5317102 para N.º registo 5889266
N.º registo 5317136 para N.º registo 5889316
Celecoxib refta para Celecoxib ratiopharm
N.º registo 5478060 para N.º registo 5895834
N.º registo 5478078 para N.º registo 5895842
Sertralina Generis para Sertralina Generis Phar
N.º registo 4884680 para N.º registo 5740816
N.º registo 4884888 para N.º registo 5740824
N.º registo 4885182 para N.º registo 5740840
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
Atualização na Comercialização de Medicamentos
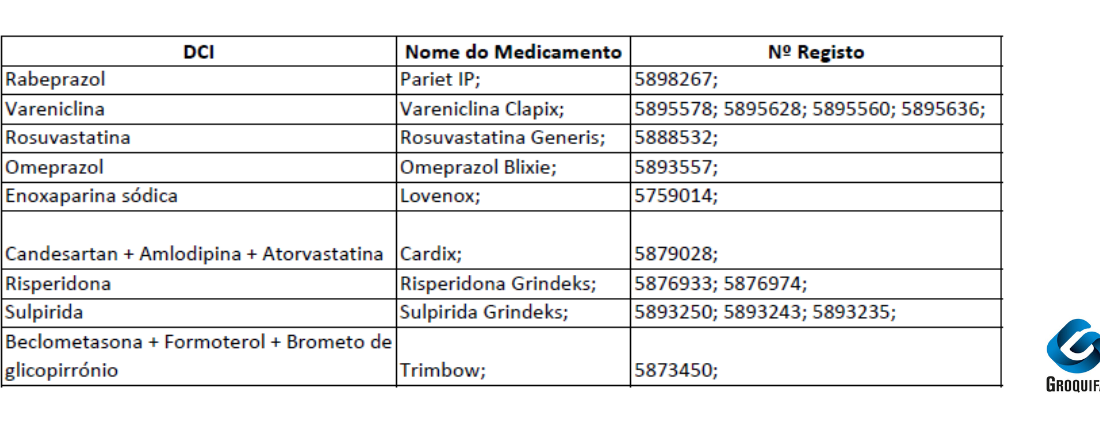
A partir de 1 de agosto de 2025, iniciam-se as alterações na comercialização dos medicamentos comparticipados presentes na imagem acima representada.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
-Bilastina Pharmakern para Bilastina Pharmakern
N.º registo 5816517 para N.º registo 5816525
-Mirtazapina ratiopharm para Mirtazapina refta
N.º registo 5930482 para N.º registo 5860531
N.º registo 5569181 para N.º registo 5860549
-Sertralina Generis para Sertralina Generis Phar
N.º registo 4884680 para N.º registo 5740816
N.º registo 4884888 para N.º registo 5740824
N.º registo 4885182 para N.º registo 5740840
-Omeprazol Blixie para Omeprazol Tecnigen
N.º registo 2978195 para N.º registo 5879341
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
Distribuição de medicamentos: novas listas em vigor
🚨Distribuição de medicamentos: novas listas em vigor
Foi publicada a Circular Informativa n.º 081/CD/100.20.200 de 09/07/2025, com atualizações importantes no âmbito da notificação prévia de transações de medicamentos para o exterior.
Principais alterações:
-Atualização da lista de medicamentos cuja exportação ou distribuição para outros Estados-Membros da UE exige notificação prévia ao INFARMED, I.P. (Deliberação n.º 075/CD/2025)
-Nova lista de medicamentos com exportação temporariamente suspensa, abrangendo:
Medicamentos críticos em rutura durante o mês de junho
Medicamentos com fornecimento ao abrigo de autorização de utilização excecional (Deliberação n.º 074/CD/2025)
As listas entram em vigor no dia útil seguinte ao da sua publicação.
A plataforma SiExp será igualmente atualizada para refletir estas alterações.
Mais informações consulte: Atualização das listas previstas no Regulamento sobre o controlo de transações de medicamentos para o exterior do país – julho 2025 – INFARMED, I.P.
Exportação de Medicamentos Temporariamente Suspensa
A Deliberação n.º 055/CD/2025, de 30 de abril, atualiza a lista de medicamentos cuja exportação está temporariamente suspensa.
Esta medida visa garantir o abastecimento normal dos medicamentos críticos que estiveram em rutura em abril e daqueles fornecidos sob autorização excecional.
Consulte a lista completa aqui: Gestão da disponibilidade do medicamento – INFARMED, I.P.
Infarmed publica nova circular informativa
O Infarmed publicou nova Circular Informativa Nº 038/CD/100.20.200 de 07/04/2025, com a lista dos Grupos Homogéneos e dos preços de referência unitários a vigorar no 2º trimestre de 2025, sendo que serão incluídos 4 grupos homogéneos repristinados repristinados (GH0912; GH1083; Gh1219 e GH1223) e 3 Novo grupo homogéneo (GH1303; GH1304 e GH1305) para os quais foi aprovado o respetivo preço de referência.
Estes Grupos Homogéneo entrarão em vigor dia 1 de maio de 2025.
Mais informações consulte: Sistema de Preços de Referência – INFARMED, I.P.
Nova Circular Informativa sobre gestão de disponibilidade de medicamentos
O Infarmed publicou nova Circular Informativa nº 041/CD/100.20.200 no dia 8 de abril de 2025 com a atualização da lista de medicamentos cuja exportação é temporariamente suspensa.
A garantia do acesso dos cidadãos aos medicamentos de que necessitam assume-se como uma das mais relevantes vertentes do direito fundamental à proteção da saúde. Esta suspensão visa assegurar a normalização do abastecimento dos medicamentos críticos que estiveram em rutura no mês de março, bem como dos medicamentos que estão a ser abastecidos ao abrigo de autorização de utilização excecional.
Para mais informações consulte: Gestão da disponibilidade do medicamento – INFARMED, I.P.
Regulamento sobre o controlo de transações de medicamentos para o exterior do país
O Infarmed publicou nova Circular Informativa acerca da Deliberação n.º 234/2025, de 18 de fevereiro, acerca do Regulamento sobre o controlo de transações de medicamentos para o exterior do país, atualizando os fatores para a elaboração da lista de notificação prévia (LNP) e da lista de medicamentos com exportação ou distribuição temporariamente suspensa.
Para informações adicionais, consulte a área do Controlo da Disponibilidade.
Atualização das listas sobre notificação prévia de transações de medicamentos para o exterior do país (dezembro de 2024)
Como refere a Circular Informativa n.º 107/CD/100.20.200 do Infarmed foram atualizadas as listas anexas ao Regulamento sobre notificação prévia de transações de medicamentos para o exterior do país.
Estas são a lista de medicamentos cuja exportação, ou distribuição para outros Estados-membros da União Europeia, e respetivas quantidades dependem de prévia notificação pelo distribuidor por grosso ao INFARMED, I.P. e a de medicamentos cuja exportação é temporariamente suspensa, e que abrange todos os medicamentos críticos que estiveram em rutura no mês de novembro, bem como os medicamentos que estejam a ser abastecidos ao abrigo de autorização de utilização excecional.
Estas listas entram em vigor no dia útil seguinte ao da sua publicação.
Para saber mais e consultar as listas em formato eletrónico, clique aqui.
Revisão Anual de Preços 2025
No passado dia 15 de novembro, o Infarmed publicou a Portaria nº293/2024/1 referente à definição dos países de referência para a autorização dos preços de novos medicamentos e para efeitos de revisão anual de preços (RAP) dos medicamentos adquiridos pelos estabelecimentos e serviços do SNS e dos medicamentos dispensados no âmbito do mercado de ambulatório.
A Portaria define ainda os critérios excecionais a aplicar no regime de revisão anual de preços.
Para o ano de 2025, os países de referência são Espanha, França, Itália e Bélgica sendo que alguns dos critérios excecionais incidem em:
-
“Todos os medicamentos (Não Genéricos e Genéricos) com preço de venda ao público (PVP) máximo inferior ou igual a € 16,00 podem ser aumentados até ao máximo de 2,6% face ao PVP máximo em vigor à data de publicação da presente portaria;”
-
“Todos os medicamentos (Não Genéricos) com PVP máximo (PVP Máx) inferior ou igual a € 16,00 ficam isentos da aplicação do regime de revisão anual de preços previsto no artigo 16.º da Portaria n.º 195C/2015, de 30 de junho, na sua redação atual.”