Criação da Sociedade Diverde
No passado dia 5 de setembro, foi constituída formalmente a Sociedade Diverde, entidade gestora de resíduos de autocuidados de saúde no domicílio, nomeadamente de resíduos corto-perfurantes, como seringas, agulhas e lancetas.
Esta sociedade é constituída pela ANF, APIFARMA, ADIFA e GROQUIFAR.
Mais informações consulte: https://www.anf.pt/noticias/sociedade-diverde-cria-sistema-nacional-para-gestao-de-residuos-de-autocuidados-de-saude-domiciliarios/
📢 Atualização na Comercialização de Medicamentos
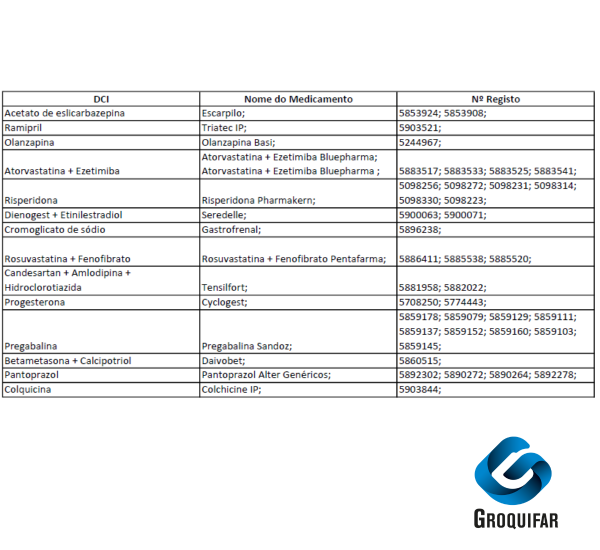
A partir de hoje, 1 de setembro de 2025, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
Atorvastatina Zidrium para Atorvastatina Teva
N.º registo 5317037 para N.º registo 5889209
N.º registo 5317052 para N.º registo 5889233
N.º registo 5317102 para N.º registo 5889266
N.º registo 5317136 para N.º registo 5889316
Celecoxib refta para Celecoxib ratiopharm
N.º registo 5478060 para N.º registo 5895834
N.º registo 5478078 para N.º registo 5895842
Sertralina Generis para Sertralina Generis Phar
N.º registo 4884680 para N.º registo 5740816
N.º registo 4884888 para N.º registo 5740824
N.º registo 4885182 para N.º registo 5740840
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
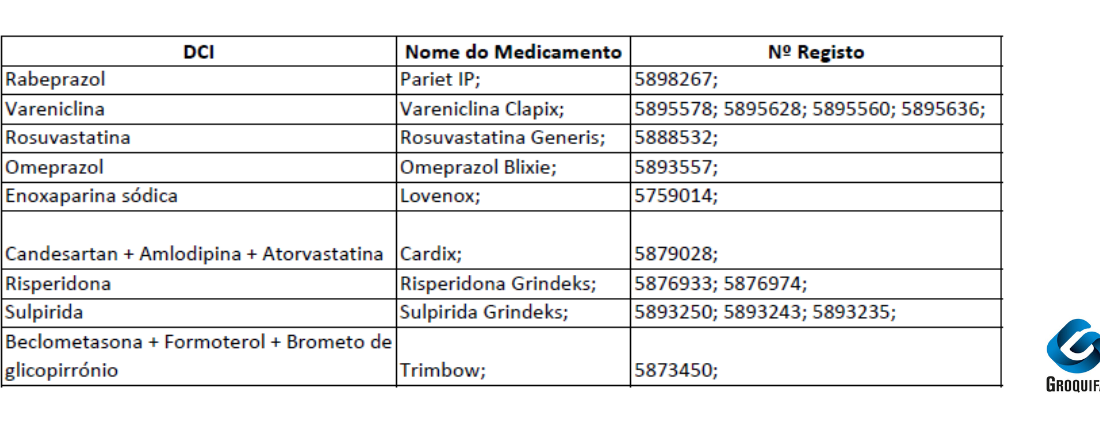
Atualização na Comercialização de Medicamentos
A partir de 1 de agosto de 2025, iniciam-se as alterações na comercialização dos medicamentos comparticipados presentes na imagem acima representada.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
-Bilastina Pharmakern para Bilastina Pharmakern
N.º registo 5816517 para N.º registo 5816525
-Mirtazapina ratiopharm para Mirtazapina refta
N.º registo 5930482 para N.º registo 5860531
N.º registo 5569181 para N.º registo 5860549
-Sertralina Generis para Sertralina Generis Phar
N.º registo 4884680 para N.º registo 5740816
N.º registo 4884888 para N.º registo 5740824
N.º registo 4885182 para N.º registo 5740840
-Omeprazol Blixie para Omeprazol Tecnigen
N.º registo 2978195 para N.º registo 5879341
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
Preços de Referência | Novos grupos homogéneos
Já está disponível a atualização da lista de Grupos Homogéneos e dos preços de referência unitários para o 3.º trimestre de 2025.
Consulte a informação completa na área do Sistema de Preços de Referência, incluindo:
–Circular Informativa n.º 082/CD/100.20.200
– Deliberação n.º 076/CD/2025
Mais informações consulte: https://www.infarmed.pt/web/infarmed/entidades/medicamentos-uso-humano/avaliacao-tecnologias-saude/avaliacao-terapeutica-e-economica/sistema-de-precos-de-referencia
Alegações com produtos cosméticos
O INFARMED publicou no passado dia 14 de julho de 2025, a Circular Informativa Nº 085/CD/100.20.200 sobre o Regulamento da Comissão (EU) nº655/2013 que estabelece normas e critérios comuns para a fundamentação de alegações com produtos cosméticos.
Este regulamento tem como objetivo proteger os utilizadores finais de declarações enganosas e permitir-lhes tomar decisões informadas na hora da escolha dos produtos que melhor se adequam às suas necessidades.
Antevendo possíveis constrangimentos na aplicação deste Regulamento, o Infarmed publicou previamente duas circulares informativas: nº106/CD/100.20.200, de 27 de julho de 2018, e a nº097/CD/550.20.00, de 5 de junho de 2019. No entanto, verificou-se a existência de alegações no mercado de produtos cosméticos que violam os critérios de imparcialidade e de tomada de decisão do consumidor.
Atendendo ao acima exposto, devem ser tomadas as seguintes medidas:
-
As entidades (Pessoa Responsável ou Distribuidores) que colocam no mercado nacional produtos cosméticos deverão adotar as medidas consideradas necessárias de forma a repor a conformidade no que respeita às alegações constantes nos produtos que disponibilizam.
-
Na ausência da adoção de medidas corretivas num prazo razoável, serão adotadas as medidas legalmente previstas no Decreto-Lei 23/2025, de 19 de março.
Mais informações consulte: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/11449083