Atualização – Sistema de Preços de Referência | 1.º trimestre 2026
Foram atualizados os Grupos Homogéneos e os preços de referência unitários para o 1.º trimestre de 2026.
Consulte a Circular Informativa N.º 014/CD/100.20.200 (09/02/2026) e a Deliberação N.º 009/CD/2026 (05/02/2026) na área do Sistema de Preços de Referência.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12472236
Atualização – fevereiro 2026
🚨 Foi atualizada a lista de medicamentos com exportação temporariamente suspensa (Deliberação n.º 008/CD/2026), com o objetivo de normalizar o abastecimento de medicamentos críticos em rutura, medicamentos ao abrigo de autorização de utilização excecional e todos os que contêm quetiapina.
A lista está disponível na área de Gestão da Disponibilidade do Medicamento: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12472433
Atualização de listas de medicamentos | janeiro 2026
O INFARMED, I.P. atualizou as listas do Regulamento sobre a notificação prévia de transações de medicamentos para o exterior do país.
Inclui:
• Medicamentos sujeitos a notificação prévia para exportação/distribuição na UE
• Medicamentos com exportação temporariamente suspensa (críticos, AUE e quetiapina)
Em vigor no dia útil seguinte à publicação.
Plataforma SiExp será atualizada.
 Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12307601
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12307601
A lista dos Grupos Homogéneos e dos preços de referência unitários a vigorar no 1.º trimestre de 2026 foi aprovada e entra em vigor a 1 de janeiro de 2026.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12237933
Atualização na Comercialização de Medicamentos
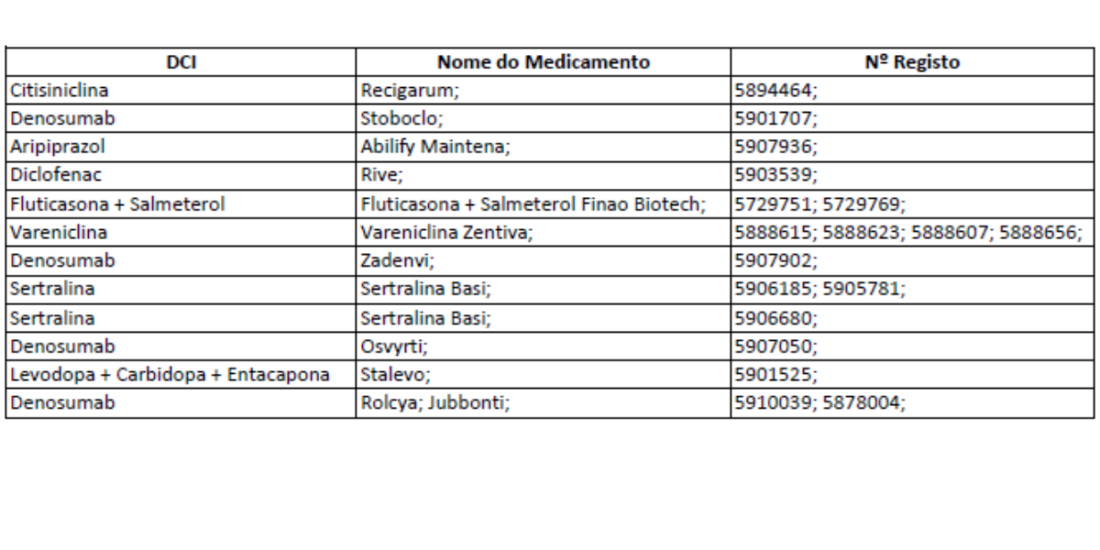
A partir de 1 de janeiro de 2026, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
-Ramipril Romace para Ramipril Blixie
N.º registo 4866885 para N.º registo 5885256
N.º registo 4867081 para N.º registo 5885264
N.º registo 4867685 para N.º registo 5885322
N.º registo 4868287 para N.º registo 5885363
N.º registo 4868881 para N.º registo 5885421
-Rybelsus para Rybelsus
N.º registo 5794904 para N.º registo 5887013
N.º registo 5794912 para N.º registo 5887005
N.º registo 5794938 para N.º registo 5886973
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
Medicamentos atualizados
📢 Foi atualizada a lista de medicamentos cuja exportação se encontra temporariamente suspensa.
A Deliberação n.º 127/CD/2025 atualiza esta lista que tem como objetivo assegurar a normalização do abastecimento:
dos medicamentos críticos que estiveram em rutura no mês de novembro;
e dos medicamentos atualmente abastecidos ao abrigo de autorização de utilização excecional.
A lista em formato eletrónico está disponível na área de Gestão da disponibilidade do medicamento.
Uma decisão preventiva que reforça a segurança no acesso aos medicamentos essenciais.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12118139
1ª Atualização Anual da Lista de Medicamentos Críticos
Foi publicada a 1ª atualização anual da lista de medicamentos críticos da União Europeia, no passado dia 12 de dezembro de 2025.
A Agência Europeia de Medicamentos (EMA), em articulação com os Chefes das Agências de Medicamentos (HMA) e a Comissão Europeia, publicou este instrumento fundamental para prevenir ruturas de abastecimento e garantir a disponibilidade de medicamentos essenciais na UE, reforçando uma abordagem coordenada e preventiva entre as autoridades reguladoras.
A lista inclui medicamentos de uso humano considerados essenciais para o bom funcionamento dos sistemas de saúde, abrangendo medicamentos inovadores e genéricos, em áreas como vacinas, doenças raras e outras áreas terapêuticas críticas.
📌 Atualização anual
Em 2025, foram avaliadas 61 substâncias ativas adicionais, com a inclusão de nove novos grupos de substâncias. Atualmente, a lista cobre cerca de 75% dos medicamentos autorizados na UE.
Os medicamentos identificados passam a ser prioritários para ações a nível europeu, com foco no reforço das cadeias de abastecimento e na mitigação de riscos de interrupção.
O INFARMED, I.P. acompanhou e contribuiu ativamente para o processo de revisão da lista.
👉 Saiba mais aqui: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12177634
Alteração ao SIATS | Submissão dos novos preços RAP 2026
O SIATS foi otimizado para facilitar a submissão dos novos preços de medicamentos não genéricos e não biossimilares, que entrarão em vigor a 01 de janeiro de 2026.
Assista ao vídeo ilustrativo e veja como a submissão foi simplificada.
Mais informações aqui: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12069668
Atualização na Comercialização de Medicamentos
A partir de 1 de dezembro de 2025, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
-Twinrix Adulto para Twinrix Adulto
N.º registo 2591683 para N.º registo 2441889
-Atorvastatina Mylan para Atorvastatina Mylan
N.º registo 5434857 para N.º registo 5900105
N.º registo 5434923 para N.º registo 5900121
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
Atualização importante | INFARMED, I.P.
Foram atualizadas as listas anexas ao Regulamento sobre notificação prévia de transações de medicamentos para o exterior do país:
🔹 Lista de medicamentos com exportação sujeita a notificação prévia pelo distribuidor por grosso ao INFARMED, I.P. (Deliberação n.º 99/CD/2025)
🔹 Lista de medicamentos com exportação temporariamente suspensa, abrangendo medicamentos críticos em rutura em setembro e os fornecidos com autorização de utilização excecional (Deliberação n.º 100/CD/2025)
As listas entram em vigor no dia útil seguinte ao da sua publicação.
Mais informações consulte: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/11749422