Manual de Rotulagem de Produtos Fitofarmacêuticos
Já consultou no Portal da DGAV a mais recente versão do Manual de Rotulagem de Produtos Fitofarmacêuticos?
Este manual foi produzido com vista a auxiliar os requerentes de autorizações de venda de produtos fitofarmacêuticos, na rotulagem dos seus produtos em conformidade com a legislação nacional e comunitária em vigor aplicável à classificação, embalagem e rotulagem de produtos fitofarmacêuticos.
O manual estará disponível em permanência juntamente com os restantes documentos relativos a procedimentos para a colocação no mercado de produtos fitofarmacêuticos, sendo actualizado sempre que seja justificado.
Consulte aqui o Manual de Rotulagem.
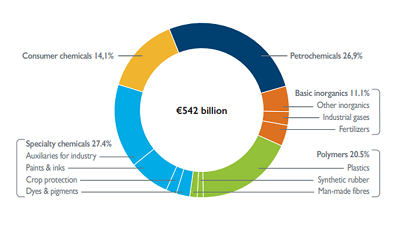
Petroquímicos e químicos de especialidade representam metade das vendas de produtos químicos na União Europeia
Os produtos químicos de base representaram em 2017, 58,5% do número total das vendas de produtos químicos da UE. Já as especialidades química são produzidas em pequenos volumes, mas representam 24,7% do total de vendas de produtos químicos da UE em 2017. Os produtos químicos representaram 14,1% do total de vendas de produtos químicos da UE em 2017. E por fim, os produtos químicos e petroquímicos representaram a maioria – 54,3% – dos produtos químicos vendidos na UE em 2017.
Fonte: “Facts & Figures of the European chemical industry” do CEFIC
Nova lista de Produtos Fitofarmacêuticos
Foi publicada nova lista oficial de Produtos Fitofarmacêuticos.
Continue ReadingMercado de serviços de Gestão de Pragas na Europa deverá atingir 4 mil milhões de dólares até 2025
A Allied Market Research publicou recentemente um relatório intitulado “Europe Pest Control Services Market”.
De acordo com este relatório, o mercado de serviços de Gestão de Pragas na Europa gerou 2,51 mil milhões de dólares em 2017 e está previsto vir a atingir 4,02 mil milhões até 2025.
As alterações climáticas, a fácil disponibilidade de produtos de controlo de pragas e a presença de grandes entidades reguladoras, bem como dos principais intervenientes no mercado de serviços de gestão de pragas, alimentaram o crescimento do mercado na Europa. Por outro lado, vários riscos à saúde pública relacionados com os produtos químicos de controlo de pragas, impediriam o crescimento do mercado em certa medida. No entanto, o desenvolvimento e lançamento consistente de produtos criaram várias oportunidades para o mercado.
Fonte: Pest Control Technology
Com que finalidade são utilizados os produtos fitofarmacêuticos?
Os Produtos Fitofarmacêuticos têm como objetivo proteger as plantas cultivadas contra os seus inimigos, sendo essenciais para a sua produção tanto em quantidade como em qualidade.
Tal como os medicamentos, se mal utilizados, os produtos fitofarmacêuticos podem ser perigosos. Por isso, existe legislação específica e regras muito rigorosas que são obrigatórias para a sua produção, homologação, transporte, armazenamento, venda e aplicação.
Assim, as Empresas Distribuidoras de Produtos Fitofarmacêuticos que são Associadas da Groquifar, estão devidamente licenciadas e, com todo o rigor e empenho, cumprem diariamente o seu papel no Uso Sustentável de Pesticidas, protegendo a saúde pública e o ambiente.
Disponibilização gratuita do Cartaz “Venda Responsável” de Produtos Fitofarmacêuticos aos Associados da Groquifar em A3 (42cm x 30cm) para afixação nos balcões de venda. Contacte-nos através de comunicacao@groquifar.pt
Inscrições para FECC Young Talent abertas
É um jovem profissional que trabalha no setor químico? É inteligente, ambicioso e quer moldar o seu futuro? Quer interagir com um painel de líderes, executivos e especialistas?
Então esta é a sua oportunidade! Inscreva-se com um tweet no #FeccYoungTalent explicando por que deve ser selecionado para participar como orador no Congresso FECC em Sitges para discutir o futuro da Distribuição de Produtos Químicos.
Os dois melhores candidatos estarão presentes no Congresso com despesas de viagem e alojamento, taxas de inscrição e participação no Jantar de Gala oferecidas pela FECC.
Tem de ter menos de 35 anos para se inscrever e no seu tweet tem apenas de acrescentar um link relevante (conta de LinkedIn ou perfil no site da empresa onde trabalha, por exemplo) à hashtag #FeccYoungTalent até ao dia 1 de Maio de 2019.
Mais informações aqui.
Compreender o comportamento das baratas
As baratas têm vindo a evoluir para explorarem os diferentes ambientes urbanos, onde as estruturas que a sociedade constrói fornecem um número infinito de portos, calor, comida e humidade.
Steve Broadbent, da Ensystex, através de um artigo publicado no site da British Pest Control Association, explica que ao entender as baratas e as interações sociais, se pode maximizar o número de colocação de iscos para as apanhar.
Ler notícia na íntegra aqui.
7ª edição dos prémios Valorfito distingue boas práticas do setor agrícola português
No passado dia 29 de março, em Coimbra, 12 empresas portuguesas foram distinguidas na 7ª Edição dos Prémios Valorfito.
A sustentabilidade do setor agrícola português esteve em destaque neste encontro anual que visa reconhecer e mobilizar o setor agrícola e convidar todos os parceiros para o debate e reflexão sobre o estado da atividade.
Os números de 2018 trazem novidades não só no que respeita ao crescimento das taxas de recolha, mas também desafios de crescimento nacional para um setor que cada vez mais está preocupado com o caminho para a eficiência e sustentabilidade da agricultura.
Saiba mais sobre os Prémios Valorfito aqui.
Foto: Dr. Joaquim Cabeça, representante da Groquifar no Valorfito.
Nova lista de Produtos Fitofarmacêuticos
Foi publicada nova lista oficial de Produtos Fitofarmacêuticos.
Continue Reading