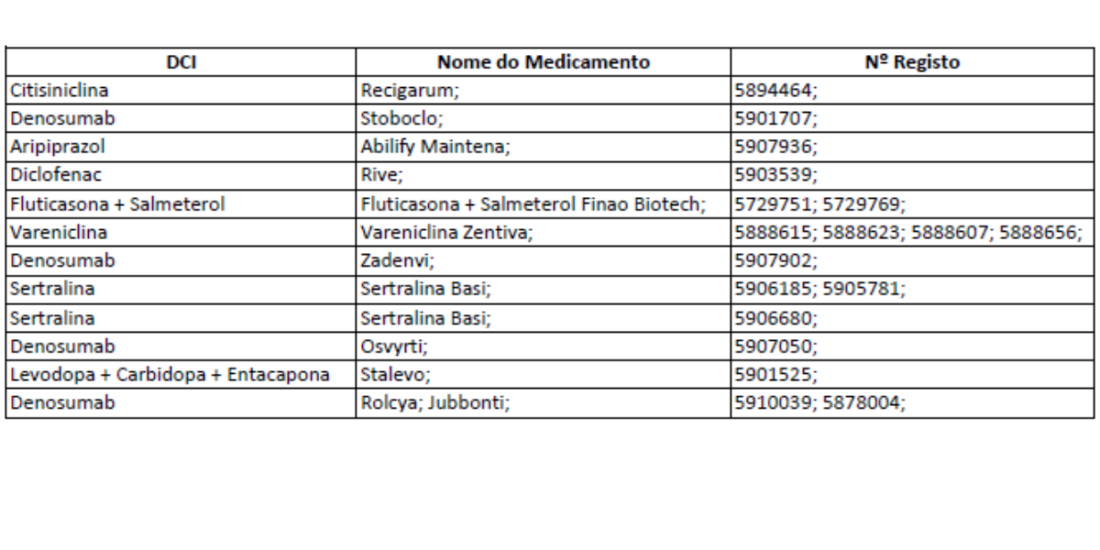
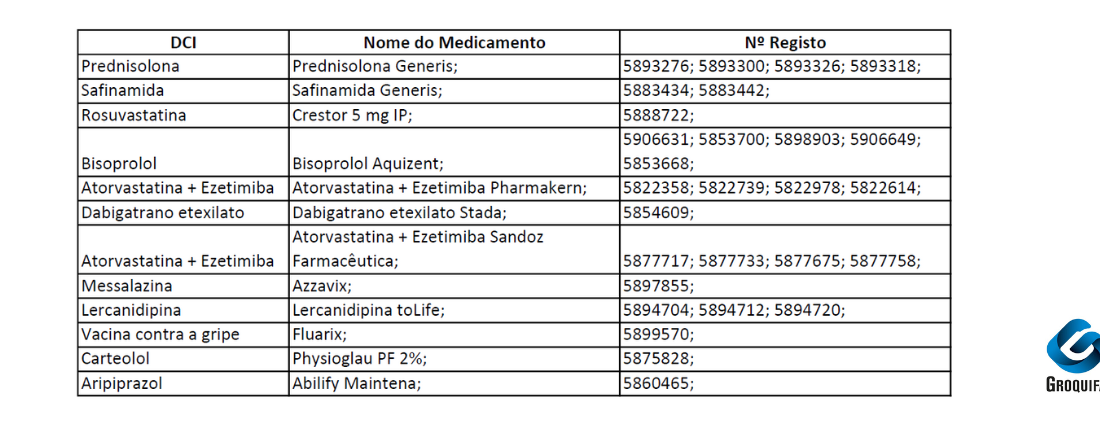
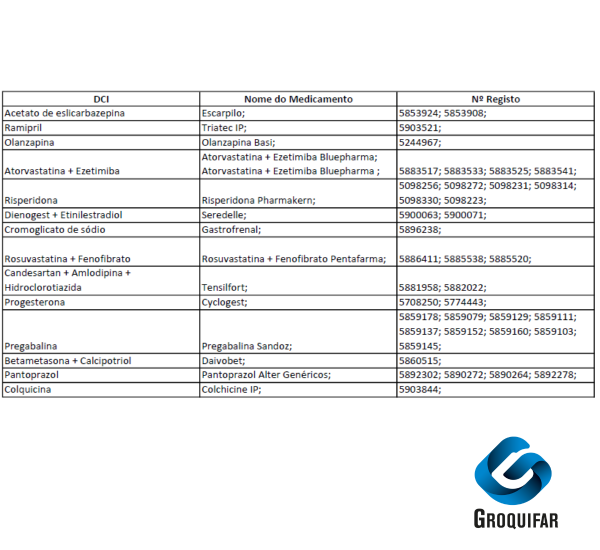
Atualização na Comercialização de Medicamentos
A partir de 1 de dezembro de 2025, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
-Twinrix Adulto para Twinrix Adulto
N.º registo 2591683 para N.º registo 2441889
-Atorvastatina Mylan para Atorvastatina Mylan
N.º registo 5434857 para N.º registo 5900105
N.º registo 5434923 para N.º registo 5900121
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
Atualização da lista de medicamentos com exportação temporariamente suspensa
Atualização da lista de medicamentos com exportação temporariamente suspensa
Foi publicada a Circular Informativa n.º 129/CD/100.20.200 de 07/11/2025, que divulga a Deliberação n.º 113/CD/2025, a qual atualiza a lista de medicamentos cuja exportação se encontra temporariamente suspensa.
Esta medida tem como objetivo assegurar a normalização do abastecimento dos medicamentos críticos que estiveram em rutura durante o mês de outubro, bem como dos medicamentos que estão a ser fornecidos ao abrigo de autorizações de utilização excecional.
A lista eletrónica atualizada está disponível na área Gestão da disponibilidade do medicamento.~
Saiba mais em: Atualização da lista de medicamentos cuja exportação é temporariamente suspensa | novembro de 2025 – INFARMED, I.P.
Sistema de Preços de Referência | Aditamento de novos grupos homogéneos (4.º trimestre de 2025)
📢 O INFARMED, I.P. atualizou a lista dos Grupos Homogéneos e dos preços de referência unitários a vigorar no 4.º trimestre de 2025, no âmbito do Sistema de Preços de Referência, conforme circular informativa nº 114/ CD/ 100.20.200.
🗓️ A partir de 1 de novembro de 2025, entra em vigor a deliberação do Conselho Diretivo que aprova os novos Grupos Homogéneos, incluindo a repristinação do GH1219, com o respetivo preço de referência aprovado.
Saiba mais em: https://lnkd.in/dWehAbyg
Atualização importante | INFARMED, I.P.
Foram atualizadas as listas anexas ao Regulamento sobre notificação prévia de transações de medicamentos para o exterior do país:
🔹 Lista de medicamentos com exportação sujeita a notificação prévia pelo distribuidor por grosso ao INFARMED, I.P. (Deliberação n.º 99/CD/2025)
🔹 Lista de medicamentos com exportação temporariamente suspensa, abrangendo medicamentos críticos em rutura em setembro e os fornecidos com autorização de utilização excecional (Deliberação n.º 100/CD/2025)
As listas entram em vigor no dia útil seguinte ao da sua publicação.
Mais informações consulte: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/11749422
Atualização na Comercialização de Medicamentos
📢 Atualização na Comercialização de Medicamentos
A partir de 1 de outubro de 2025, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
– Ramipril Sandoz para Ramipril Sandoz
N.º registo 5667183 para N.º registo 5602669
N.º registo 5667381 para N.º registo 5602677
N.º registo 5666987 para N.º registo 5602701
– Clopidogrel Kaissan para Clopidogrel Mesiproc
N.º registo 5207550 para N.º registo 5267414
– Atorvastatina Ratiopharm para Atorvastatina Refta
N.º registo 5416649 para N.º registo 5889340
N.º registo 5416664 para N.º registo 5889373
N.º registo 5416714 para N.º registo 5889423
– Celecoxib Ratiopharm para Celecoxib Refta
N.º registo 5487053 para N.º registo 5895859
N.º registo 5487061 para N.º registo 5895867
– Fluoxetina Generis Phar para Fluoxetina Generis
N.º registo 3653680 para N.º registo 5730270
N.º registo 4582284 para N.º registo 5730304
– Clopidogrel Generis Phar para Clopidogrel Aurobindo
N.º registo 5209408 para N.º registo 5727615
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.
.
#Groquifar #Medicamentos #Saúde #Farmacêutica
Nova Tabela dos Grupos Homogéneos
Foi aprovada a nova tabela dos Grupos Homogéneos e respetivos preços de referência unitários, que entra em vigor a partir de 1 de outubro de 2025, para o 4.º trimestre do ano.
Para mais informações consulte: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/11628522
Campanha de Vacinação Sazonal 2025/2026
É já no próximo dia 23 de setembro, que a Campanha de Vacinação Sazonal 2025/2026 contra a Gripe e a Covid-19, começa!
📍Novidade importante:
A vacinação contra a gripe passa a ser gratuita para todas as crianças entre os 6 e os 23 meses de idade, uma faixa etária com níveis de hospitalização semelhantes aos registados em pessoas idosas. A DGS recomenda também a vacinação de crianças entre os 2 e os 4 anos.
Reforçando o seu compromisso com a saúde pública, a GROQUIFAR volta a integrar o grupo de trabalho da campanha de vacinação sazonal, sob coordenação da Direção Executiva do Serviço Nacional de Saúde (DE-SNS), contribuindo ativamente para o sucesso da iniciativa.
Atualização de medicamentos com exportação
💊 Foi publicada a Deliberação n.º 96/CD/2025, que atualiza a lista de medicamentos com exportação temporariamente suspensa.
Esta medida visa garantir a normalização do abastecimento dos medicamentos críticos que estiveram em rutura em agosto, bem como daqueles que estão a ser abastecidos com autorização de utilização excecional.
A lista completa está disponível, em formato eletrónico, na área de Gestão da Disponibilidade do Medicamento.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/11603253
Criação da Sociedade Diverde
No passado dia 5 de setembro, foi constituída formalmente a Sociedade Diverde, entidade gestora de resíduos de autocuidados de saúde no domicílio, nomeadamente de resíduos corto-perfurantes, como seringas, agulhas e lancetas.
Esta sociedade é constituída pela ANF, APIFARMA, ADIFA e GROQUIFAR.
Mais informações consulte: https://www.anf.pt/noticias/sociedade-diverde-cria-sistema-nacional-para-gestao-de-residuos-de-autocuidados-de-saude-domiciliarios/
📢 Atualização na Comercialização de Medicamentos
A partir de hoje, 1 de setembro de 2025, inicia-se o início da comercialização dos medicamentos comparticipados presentes na imagem.
– Informa-se também, que decorrente de transferência de comparticipação, existiu uma notificação de início de comercialização dos seguintes medicamentos:
Atorvastatina Zidrium para Atorvastatina Teva
N.º registo 5317037 para N.º registo 5889209
N.º registo 5317052 para N.º registo 5889233
N.º registo 5317102 para N.º registo 5889266
N.º registo 5317136 para N.º registo 5889316
Celecoxib refta para Celecoxib ratiopharm
N.º registo 5478060 para N.º registo 5895834
N.º registo 5478078 para N.º registo 5895842
Sertralina Generis para Sertralina Generis Phar
N.º registo 4884680 para N.º registo 5740816
N.º registo 4884888 para N.º registo 5740824
N.º registo 4885182 para N.º registo 5740840
Para mais informações, consulte os canais oficiais ou a sua farmácia habitual.