Atualização – Sistema de Preços de Referência | 1.º trimestre 2026
Foram atualizados os Grupos Homogéneos e os preços de referência unitários para o 1.º trimestre de 2026.
Consulte a Circular Informativa N.º 014/CD/100.20.200 (09/02/2026) e a Deliberação N.º 009/CD/2026 (05/02/2026) na área do Sistema de Preços de Referência.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12472236
Atualização Regulamentar | Cosméticos
O Regulamento (UE) 2026/78 altera as regras sobre a utilização de substâncias CMR em produtos cosméticos, reforçando a proteção da saúde humana.
-Aplicável a partir de 1 de maio de 2026
-Inclui novas proibições e restrições (ex.: Hexyl Salicylate, prata, o-Phenylphenol)
O INFARMED recomenda a revisão atempada de formulações, documentação técnica e rotulagem.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12375750
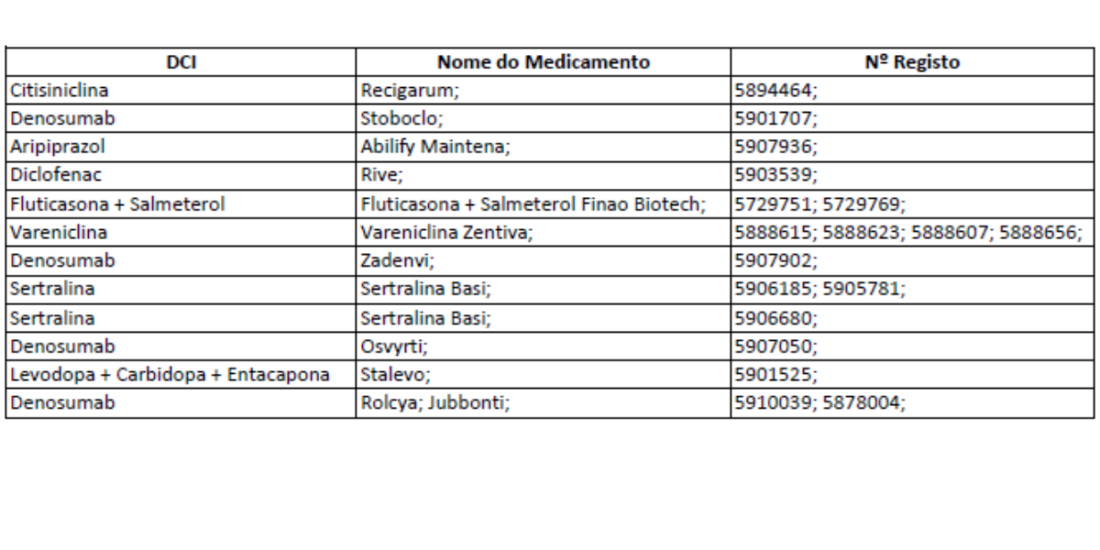
Atualização de listas de medicamentos | janeiro 2026
O INFARMED, I.P. atualizou as listas do Regulamento sobre a notificação prévia de transações de medicamentos para o exterior do país.
Inclui:
• Medicamentos sujeitos a notificação prévia para exportação/distribuição na UE
• Medicamentos com exportação temporariamente suspensa (críticos, AUE e quetiapina)
Em vigor no dia útil seguinte à publicação.
Plataforma SiExp será atualizada.
 Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12307601
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12307601
A Groquifar marcou presença no passado dia 15 de janeiro de 2026, na sessão comemorativa dos 33 anos do INFARMED, I.P., integrada na Reunião Extraordinária do Conselho Consultivo.
Uma sessão que ficou marcada pela apresentação do novo Conselho Diretivo e pela partilha das linhas estratégicas do Infarmed para 2026, onde temas como sustentabilidade, inovação, transformação digital e modernização da regulação, estiveram no centro da discussão.
Um momento de partilha e de reforço da cooperação entre os vários agentes do setor da saúde.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12332849
A lista dos Grupos Homogéneos e dos preços de referência unitários a vigorar no 1.º trimestre de 2026 foi aprovada e entra em vigor a 1 de janeiro de 2026.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12237933
Nova plataforma SIOMS
O INFARMED lança funcionalidades que permitem solicitar, pagar e emitir certificados e declarações de medicamentos de forma automática.
–Registo obrigatório a partir de 22/12/2025
–Pedidos disponíveis a partir de 30/01/2026
Registe-se: https://extranet.infarmed.pt/SIOMS-fo
Documentos assinados com selo eletrónico qualificado e códigos de verificação únicos para maior segurança e fiabilidade.
UE alcança acordo histórico sobre a reforma da legislação farmacêutica
O Parlamento Europeu, o Conselho da União Europeia e a Comissão Europeia alcançaram, a 11 de dezembro de 2025, um acordo político histórico sobre o novo Pacote Farmacêutico, a maior reforma da legislação farmacêutica da UE em mais de 20 anos.
O objetivo é melhorar o acesso dos doentes aos medicamentos e tornar o setor farmacêutico europeu mais justo, competitivo e resiliente.
A implementação está prevista num prazo de 24 meses, com aplicação mais rápida em áreas críticas.
O INFARMED acompanhou ativamente as negociações, defendendo um modelo centrado no doente, sustentável e alinhado com as necessidades de saúde pública.
➡️ O acordo segue agora para aprovação formal pelo Conselho da UE e pelo Parlamento Europeu. Após publicação no Jornal Oficial da UE, entrará em vigor.
Saiba mais em: https://www.infarmed.pt/web/infarmed/infarmed/-/journal_content/56/15786/12174566